Imagerie 3D en Fluorescence
Vos besoins, nos solutions
Pourquoi imager en 3D en fluorescence?
Lorsque votre échantillon devient trop épais, l’observation de la fluorescence est perturbée par le signal provenant des plans en dehors du plan focal. Pour palier à cette problématique on peut réaliser des « coupes optiques » , c’est à dire que l’on va couper virtuellement votre échantillon en tranches avec des méthodologies adaptées. Nous proposons 4 approches pour réaliser ces coupes optiques:
- La déconvolution GPU
- L’illumination structurée
- Le confocal
- Le spinning disk
La Déconvolution GPU
Cette méthode purement logicielle consiste à réattribuer le signal de fluorescence flou à son point d’origine. Le principe est que tout élément fluorescent imagé par un microscope subit une transformation (appelé également « convolution » ) liée aux propriétés du trajet optique. Il est possible caractériser cette transformation mathématiquement, ou bien de la mesurer en réalisant l’image en XYZ d’une bille dont la taille est inférieure à la résolution du microscope. L’image obtenue d’une telle bille est appelée PSF pour « Point Spread Function », c’est à dire la « fonction de dispersion de la lumière provenant d’un point ». Une fois cette fonction de convolution mesurée ou calculée, il est possible de faire le calcul inverse : la « déconvolution », pour passer d’une image avec du flou à une image nette.
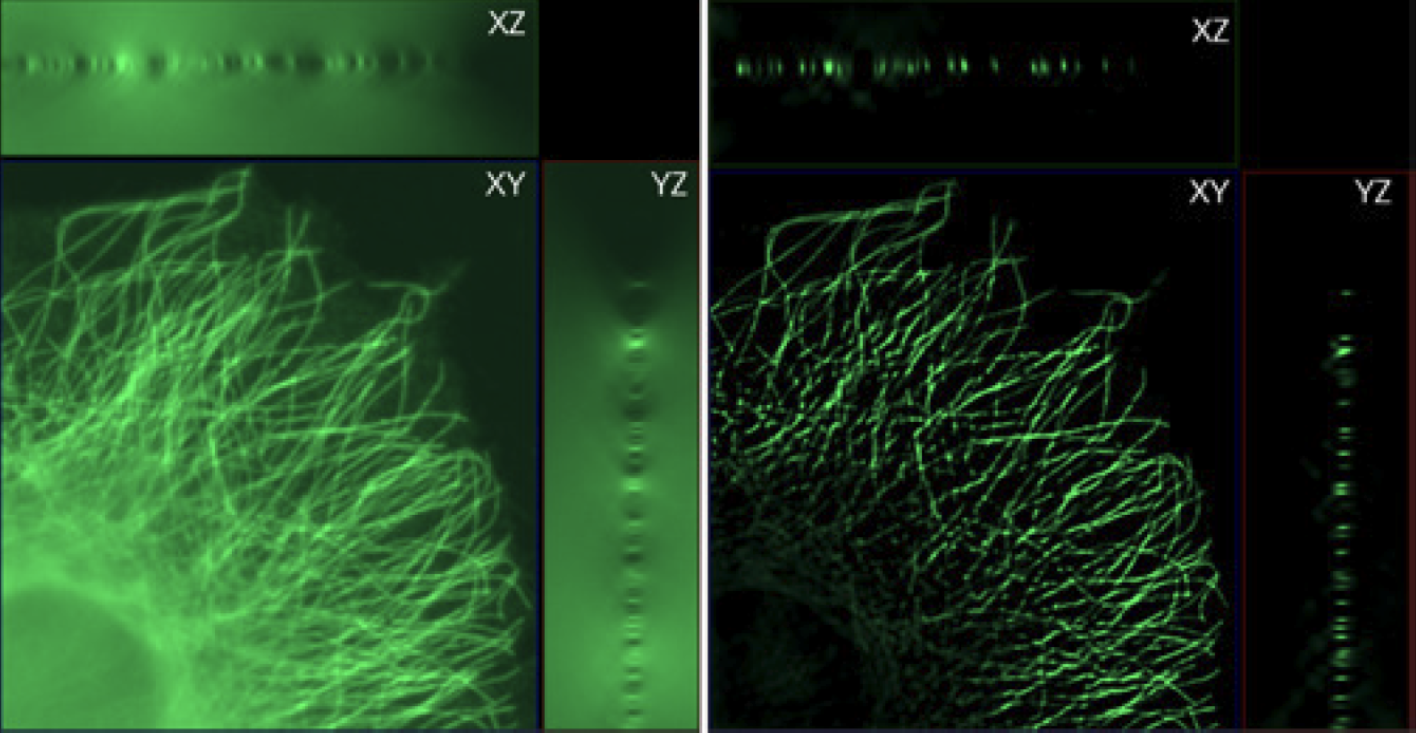
Cette méthode, très gourmande en calculs informatiques, avait pour plus grand défaut son temps de calcul. Avec l’apparition des processus de calcul dits « GPU » cette approche est à nouveau pertinente !
La solution de déconvolution GPU que nous proposons est la solution ZEN déconvolution – ZEISS. Elle permet de satisfaire les débutants avec des méthodes simples préconfigurées utilisables avec un simple clic …
… tout comme les experts grâce à l’utilisation des PSF théoriques finement ajustables mais également l’utilisation de PSF mesurées sur le système. Un didacticiel permettra de faciliter la création de PSF.
Les points forts : Pour les débutants jusqu’aux experts. Juste besoin d’un PC équipé de calcul GPU et du logiciel. On peut travailler sur un PC non relié au microscope et avec des données provenant de plusieurs microscopes différents.
L'illumination structurée
Cette méthode allie, un module permettant de projeter l’ombre d’une grille dans le plan focal et son logiciel permettant le traitement automatique des données pour retirer la fluorescence « floue ».

L’ombre d’une grille est projetée dans le plan focal, ce qui va créer un motif net (une « illumination structurée ») uniquement dans le plan focal. En modulant ce motif, le logiciel va pouvoir ainsi discriminer la fluorescence provenant du plan focal du reste et réaliser une coupe optique.

Cette technologie est éprouvée depuis plus de 15 ans, aujourd’hui nous la proposons avec la 3ième génération du module Apotome – ZEISS
Les points forts : Simple de prise en main, très efficace pour vos échantillons fixés.
Le confocal
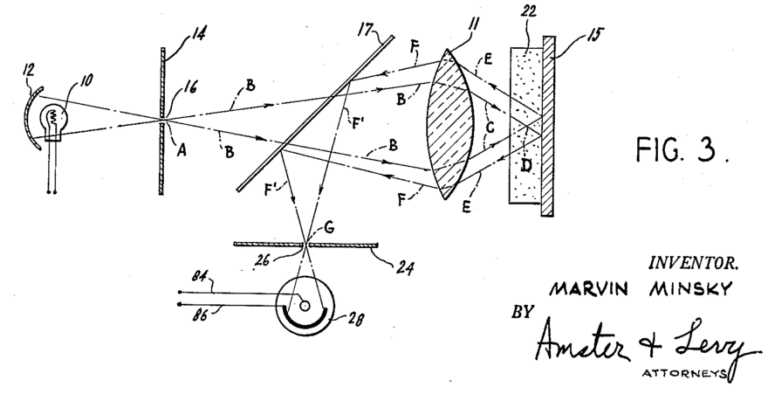
Cette méthode permet de réaliser des coupes optiques sans aucun traitement logiciel. Un spot laser est balayé sur un échantillon point par point à l’aide un scanner. La fluorescence émise suite à cette excitation est dirigée vers un pinhole (petit trou) qui bloquera fortement la fluorescence ne provenant pas du plan focal. La fluorescence d’intérêt qui passe le pinhole et sera collectée par un détecteur de type « PMT » : photo multiplicateur tube. Cette approche a été décrite dès 1957 mais reste toujours incontournable sur les plateformes d’imagerie.
Les solutions confocales de plateforme sont bien souvent difficiles à bien maitriser au regard de la multitudes des paramètres à ajuster pour réaliser une image. Choix du laser, choix du dichroïque de renvoi du laser, choix de la région d’intérêt et du Zoom, choix du nombre de pixels, choix de la vitesse de scan, choix du nombre de passages, choix du mode de scan bidirectionnel ou non, choix de la taille du pinhole, choix de la plage de collection de la lumière sur chaque détecteur, choix du mode de travail du détecteur, choix du gain du détecteur et le choix du mode de passage d’une couleur à l’autre…
Nous proposons la solution pour ceux qui souhaitent réaliser des coupes optiques par cette approche confocale mais de manière simple et efficace : le module confocal Maico – Hamamatsu. Ce module confocal comporte tous les éléments d’un confocal : laser, scanner, pinhole, filtres d’émission et détecteurs haute sensibilité GaAsP, mais avec le parti pris de la simplicité d’utilisation. Avec le Maico on ne règle que l’essentiel : on sélectionne le laser et son intensité, le gain du détecteur correspondant et on ajuste la qualité d’image grâce au moyennage des images. Les autres éléments sont optimisés et figés : Les dichroïques ainsi que les filtres d’émissions sont fixes et adaptés aux lasers utilisés (tout comme le seraient vos filtres de fluorescences sur un microscope conventionnel). Le scanner balaye toujours la même région avec le même nombre de pixels (tout comme une caméra capture toujours la même région avec la même taille de pixels sur un microscope conventionnel ).
En bref : l’imagerie confocale mais avec la simplicité d’utilisation d’une caméra!
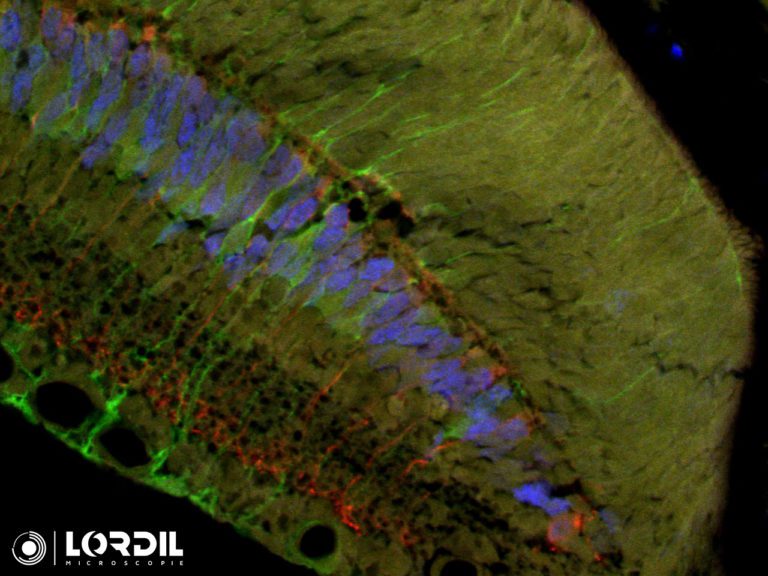

Les points forts : Il s’adapte sur tous les microscopes ayant une sortie vidéo. Simple d’utilisation. Fonctionne avec le logiciel constructeur Hamamatsu mais également avec Micromanager !
Le Spinning Disk
Si l’approche confocale permet d’obtenir une coupe optique de manière directe, lorsque la vitesse augmente la limitation sera sa capacité à collecter de la lumière efficacement en raison de sa méthode de balayage point par point. Le spinning disk va permettre de contourner cette limitation en utilisant une approche de parallélisation. L’excitation se fait au travers d’un disque contenant de nombreux « trous » formant une multitude de spots d’excitations. Ces mêmes « trous » jouent également le rôle de pinholes pour la fluorescence générée. Grâce à la rotation rapide du disque, durant le temps d’intégration de la caméra, le signal est collecté sur l’ensemble du champ d’observation de manière confocale . C’est pour cela que ce système est souvent appelé « confocal rapide » .
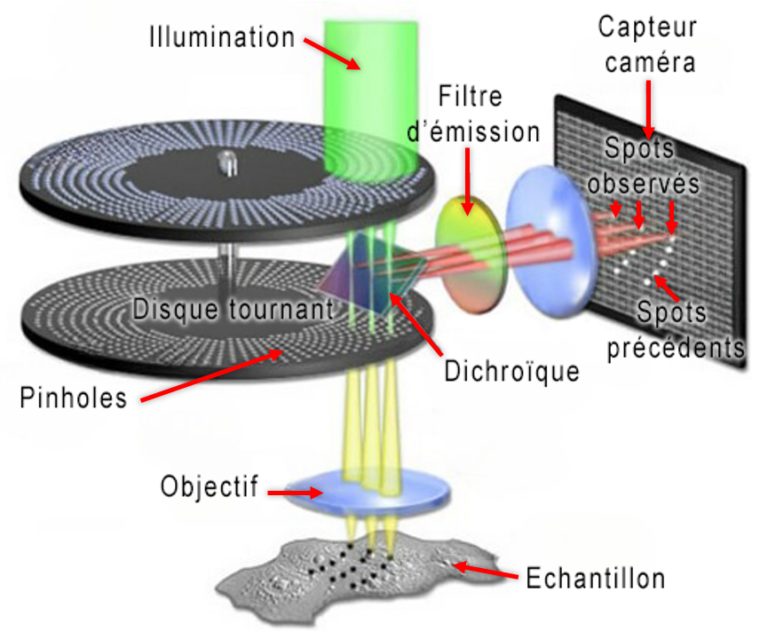
Les solutions que nous proposons sont les solutions spinning disk de la famille X-Light – CrestOptics.

Imagerie calcique sur cardiomyocyte – 330 images/secondes